Galvanische Elemente
Galvanische Elemente sind Energieumwandler, die auf elektrochemischem Weg eine Spannung erzeugen. Die Höhe der Spannung ist abhängig von der Art der Werkstoffe und von der Art und Menge des Elektrolyten.
Die Spannung entsteht dadurch, dass zwei Werkstoffe (Elektroden) in ein Elektrolyt getaucht werden. Das ist dann das galvanische Element. Metalle neigen dazu, sich im Elektrolyten aufzulösen. Dabei werden positive Ionen erzeugt. Die Elektronen bleiben auf dem metallischen Werkstoff zurück. Das Metall wird gegenüber dem Elektrolyten negativ. Es entsteht ein Ladungs- und damit ein Spannungsunterschied (-U und +U) zwischen Werkstoff und Elektrolyt.
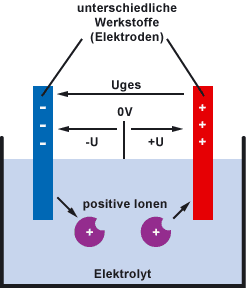
Gleichzeitig gibt es Stoffe, die sich nicht zersetzen, sondern positive Ionen anziehen. Damit wird dieser Werkstoff gegenüber dem Elektrolyten positiv. Es entsteht ein Ladungs- und damit ein Spannungsunterschied zwischen Werkstoff und Elektrolyt. Schließlich entsteht ein Spannungsunterschied zwischen den beiden Werkstoffen bzw. Elektroden (Uges).
Elektrochemische Spannungsreihe (Normalpotentiale)
Metalle, die gegenüber einer Wasserstoff-Elektrode eine positive Spannung haben, werden als edle Metalle bezeichnet. Alle Metalle mit einer negativen Spannung werden als unedle Metalle bezeichnet.
Wasserstoff (H) gilt dabei als elektrisch neutral und hat das Potential von 0 Volt. Jedes geeignete Metall hat gegenüber Wasserstoff eine andere galvanische Spannung. Diese Spannung ist in der elektrochemischen Spannungsreihe festgehalten. Dort sind sie in der Reihenfolge ihrer galvanischen Spannung und Polarität aufgereiht.
| Metall | Nichtmetalle | Potential bei 25°C |
|---|---|---|
| Fluor (F) | + 2,87 V | |
| Gold (Au) | + 1,69 V | |
| + 1,50 V | ||
| + 1,40 V | ||
| Chlor (Cl) | + 1,36 V | |
| Chrom (Cr) | + 1,33 V | |
| Platin (Pt) | + 1,20 V | |
| Quecksilber (Hg) | + 0,85 V | |
| Silber (Ag) | + 0,80 V | |
| Braunstein (Mangandioxid) | + 0,74 V | |
| Kupfer (Cu) | + 0,35 V | |
| Kupfer (Cu) | + 0,16 V | |
| Wasserstoff (H) | 0 V | |
| Blei (Pb) | - 0,13 V | |
| Zinn (Sn) | - 0,14 V | |
| Nickel (Ni) | - 0,23 V | |
| Cadmium (Cd) | - 0,40 V | |
| Eisen (Fe) | - 0,41 V | |
| Zink (Zn) | - 0,76 V | |
| Mangan (Mn) | - 1,18 V | |
| Aluminium (Al) | - 1,66 V | |
| Magnesium (Mg) | - 2,362 V | |
| Lithium (Li) | - 3,04 V |
Hinweis: Quecksilber ist ein Metall, das sich unter Normalbedingungen in einem flüssigen Zustand befindet.
Weitere verwandte Themen:
Lernen mit Elektronik-Kompendium.de
Noch Fragen?
Bewertung und individuelles Feedback erhalten
Elektronik-Fibel
Elektronik einfach und leicht verständlich
Die Elektronik-Fibel ist ein Buch über die Grundlagen der Elektronik, Bauelemente, Schaltungstechnik und Digitaltechnik.
Elektronik-Fibel
Elektronik einfach und leicht verständlich
Die Elektronik-Fibel ist ein Buch über die Grundlagen der Elektronik, Bauelemente, Schaltungstechnik und Digitaltechnik.
Elektronik-Set Starter Edition
Elektronik erleben mit dem Elektronik-Set Starter Edition.
Perfekt für Einsteiger und Wiedereinsteiger.
Keine Lust alleine zu experimentieren?
Dann buche einen Online-Workshop Elektronik Starter zum Elektronik-Set dazu. Unsere Online-Workshops sind praxisorientiert und bietet eine grundlegende und fundierte Einarbeitung in die Elektronik.
Das Elektronik-Set der anderen Art: Der Roboter-Bausatz VARIOBOT varikabi
Der VARIOBOT varikabi ist ideal für einen spannenden Einstieg in die Elektronik. Er kommt ohne komplexe Steuerung und Programmierung aus.




